Bank Soal Kimia SMA Ikatan Hidrogen dan Gaya van der Waals
Soal
Soal Populer Hari Ini
Pak Budi memiliki sebuah peternakan ayam.
Mula-mula, ayam yang ada di peternakan pak Budi berjumlah 375 ekor.
Karena air yang tercemar, ayam-ayam di peternakan Pak Budi mati 143 ekor.
Sisa ayam yang ada di peternakan Pak Budi saat ini ada ... ekor.
Matematika
Level 2
Bilangan
Mengenal Bilangan Cacah (0-999)
Penjumlahan dan Pengurangan Bilangan Sampai 999
Kelas II
Kurikulum 2013
K13
Matematika
Lala menemukan uang di laci dengan uang seperti berikut.



(Sumber Gambar: DocPlayer.info)
Jenis uang yang ditemukan Lala adalah uang ....
Matematika
Level 2
Bilangan
Nilai dan Kesetaraan Mata Uang
Macam-Macam Jenis Uang
Kelas II
Kurikulum 2013
K13
Matematika
Dalam suatu daerah, terdapat 5 sekolah dasar.
Masing-masing sekolah dasar dapat menerima siswa baru dengan jumlah yang berbeda.

(Sumber Gambar: freepik.com dan 123rf.com)
Selisih siswa yang diterima di sekolah yang menerim siswa baru paling banyak dengan sekolah yang menerima siswa baru paling sedikit adalah ... siswa.
Matematika
Level 2
Bilangan
Mengenal Bilangan Cacah (0-999)
Membandingkan dan Mengurutkan Bilangan
Kelas II
Kurikulum 2013
K13
Matematika
Ayo, kita membersihkan rumah bersama.
Gambar yang sesuai dengan ungkapan perintah di atas adalah ....
Bahasa Indonesia
Level 2
Menulis
Ungkapan (1)
Ungkapan Ajakan
Kelas II
Kurikulum 2013
K13
Bahasa Indonesia
Perhatikan gambar berikut!


(Sumber Gambar: DocPlayer.info)
Pecahan uang yang setara dengan uang pada gambar di atas adalah ....
Matematika
Level 2
Bilangan
Nilai dan Kesetaraan Mata Uang
Kesetaraan Nilai Mata Uang
Kelas II
Kurikulum 2013
K13
Matematika
24 4 = ....
Matematika
Level 2
Bilangan
Perkalian dan Pembagian Bilangan Cacah
Perkalian dan Pembagian Bilangan Cacah
Kelas II
Kurikulum 2013
K13
Matematika
Perhatikan gambar berikut!!

(Sumber Gambar: freepik.com)
Banyaknya segi enam pada gambar di atas ada ... buah.
Matematika
Level 2
Geometri
Bangun Datar Sederhana
Ciri-Ciri Bangun Datar Sederhana
Kelas II
Kurikulum 2013
K13
Matematika
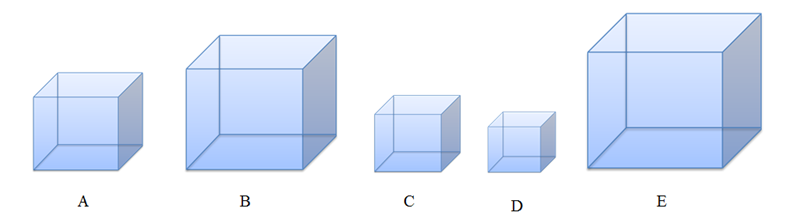
Bangun ruang di atas jika diurutkan dari yang paling besar adalah ....
Matematika
Level 2
Geometri
Bangun Ruang sederhana
Pola Barisan Bangun Ruang
Kelas II
Kurikulum 2013
K13
Matematika
Perhatikan kata-kata berikut ini!
- Rajin
- Lantai
- Menyapu
- Andi
Agar menjadi kalimat yang benar, susunan kata yang tepat adalah ....
Bahasa Indonesia
Level 2
Menulis
Kosakata dan Konsep-Lingkungan Sehat dan Tidak Sehat
Menulis Kata
Kelas II
Kurikulum 2013
K13
Bahasa Indonesia
Jam yang menunjukkan pukul 12 adalah ....
Matematika
Level 2
Bilangan
Satuan Waktu, Panjang, dan Berat
Mengenal Alat Ukur Waktu
Kelas II
Kurikulum 2013
K13
Matematika
Cek Contoh Kuis Online
Kejar Kuis
Cek Contoh Bank Soal
Kejar Soal
Pak Budi memiliki sebuah peternakan ayam.
Mula-mula, ayam yang ada di peternakan pak Budi berjumlah 375 ekor.
Karena air yang tercemar, ayam-ayam di peternakan Pak Budi mati 143 ekor.
Sisa ayam yang ada di peternakan Pak Budi saat ini ada ... ekor.
Lala menemukan uang di laci dengan uang seperti berikut.
(Sumber Gambar: DocPlayer.info)
Jenis uang yang ditemukan Lala adalah uang ....
Dalam suatu daerah, terdapat 5 sekolah dasar.
Masing-masing sekolah dasar dapat menerima siswa baru dengan jumlah yang berbeda.
(Sumber Gambar: freepik.com dan 123rf.com)
Selisih siswa yang diterima di sekolah yang menerim siswa baru paling banyak dengan sekolah yang menerima siswa baru paling sedikit adalah ... siswa.
Ayo, kita membersihkan rumah bersama.
Gambar yang sesuai dengan ungkapan perintah di atas adalah ....
Perhatikan gambar berikut!
(Sumber Gambar: DocPlayer.info)
Pecahan uang yang setara dengan uang pada gambar di atas adalah ....
24 4 = ....
Perhatikan gambar berikut!!
(Sumber Gambar: freepik.com)
Banyaknya segi enam pada gambar di atas ada ... buah.
Bangun ruang di atas jika diurutkan dari yang paling besar adalah ....
Perhatikan kata-kata berikut ini!
- Rajin
- Lantai
- Menyapu
- Andi
Agar menjadi kalimat yang benar, susunan kata yang tepat adalah ....
Jam yang menunjukkan pukul 12 adalah ....







