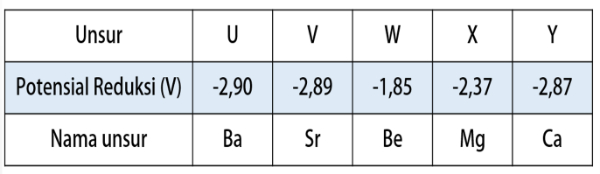
Unsur yang elektron valensinya ns2 merupakan unsur pada golongan IIA. Logam alkali tanah adalah logam yang berada pada golongan IIA.
Yang termasuk logam alkali tanah.
- Be (Berilium)
- Mg (Magnesium)
- Ca (Kalsium)
- Sr (Stronsium)
- Ba (Barium)
- Ra (Radium) - termasuk unsur radioaktif
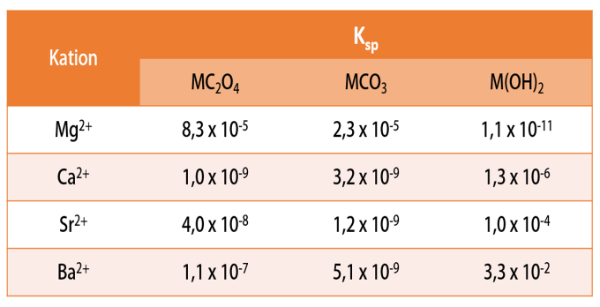
Hasil kali kelarutan (Ksp) dari garam alkali tanah sangat bermanfaat untuk penentuan proses pemisahan suatu ion alkali tanah dari ion lain dengan metode pengendapan. Semakin besar nilai Ksp maka kelarutan semakin tinggi dan semakin mudah suatu senyawa untuk larut. Pemisahan menggunakan teknik ini difokuskan untuk membuat ion lain mengendap terlebih dahulu sehingga dapat dipisahkan dari ion yang diinginkan.
Analisis opsi jawaban:
Larutan hidroksida - larutan karbonat - larutan karbonat
- Penambahan larutan hidroksida: ion magnesium mengendap sebagai Mg(OH)2 dan tersisa ion kalsium, stronsium, dan barium dalam larutan.
- Penambahan larutan karbonat: ion kalsium, stronsium, dan barium mengendap sebagai CaCO3, SrCO3, dan BaCO3 karena nilai Ksp ketiga larutan hampir sama.
- Penambahan larutan karbonat: -
- Kesimpulan: tidak diperoleh ion barium.
Larutan karbonat - larutan hidroksida - larutan oksalat
- Penambahan larutan karbonat: ion kalsium, stronsium, dan barium mengendap sebagai CaCO3, SrCO3, dan BaCO3 karena nilai Ksp ketiga larutan hampir sama sehingga tersisa ion magnesium.
- Penambahan larutan hidroksida: ion magnesium mengendap sebagai Mg(OH)2 dan tidak tersisa ion dalam larutan.
- Penambahan ion oksalat : -
- Kesimpulan: tidak diperoleh ion barium.
Larutan hidroksida - larutan karbonat - larutan hidroksida
- Penambahan larutan hidroksida: ion magnesium mengendap sebagai Mg(OH)2 dan tersisa ion kalsium, stronsium, dan barium dalam larutan.
- Penambahan larutan karbonat: ion kalsium, stronsium, dan barium mengendap sebagai CaCO3, SrCO3, dan BaCO3 karena nilai Ksp ketiga larutan hampir sama.
- Penambahan larutan hidroksida: -
- Kesimpulan: tidak diperoleh ion barium.
Larutan oksalat - larutan karbonat - larutan hidroksida
- Penambahan larutan oksalat: ion kalsium mengendap sebagai CaC2O4 dan tersisa ion magnesium, stronsium, dan barium dalam larutan.
- Penambahan larutan karbonat: ion stronsium dan barium mengendap sebagai SrCO3 dan BaCO3 karena nilai Ksp kedua larutan hampir sama sehingga tersisa ion magnesium.
- Penambahan larutan hidroksida: ion magnesium mengendap sebagai Mg(OH)2 dan tidak tersisa ion apapun.
- Kesimpulan: tidak diperoleh ion barium.
Larutan oksalat - larutan hidroksida - larutan hidroksida
- Penambahan larutan oksalat: ion kalsium mengendap sebagai CaC2O4 dan tersisa ion magnesium, stronsium, dan barium dalam larutan.
- Penambahan larutan hidroksida: ion magnesium mengendap sebagai Mg(OH)2 dan tersisa ion stronsium dan barium dalam larutan.
- Penambahan larutan hidroksida: penambahan ion hidroksida akan mengendapkan ion stronsium menjadi Sr(OH)2 sehingga tersisa ion barium dalam larutan.
- Kesimpulan: diperoleh ion barium.
Jika Maya ingin mendapatkan ion barium, maka urutan penambahan larutan yang benar adalah larutan oksalat - larutan hidroksida - larutan hidroksida.