Diketahui:
pH HCl = 3
a=1
V HCl = 100 mL
V NH3 = 50 mL
[NH3] = 0,0012 M
Ditanya: pH akhir?
Dijawab:
[H+]=10−pH
=10−3 M
[H+]=a×[HCl]
[HCl]=a[H+]
=110−3 M
=10−3M
Penentuan mol HCl
mol HCl=[HCl]×V HCl
=10−3 M×100 mL
=0,1 mmol
Penentuan mol NH3
mol NH3=[NH3]×V NH3
=0,0012 M×50 mL
=0,06 mmol
Perhatikan bagan berikut!
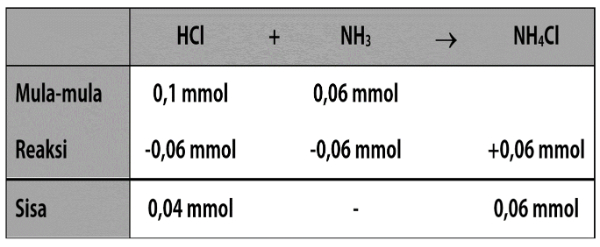
Karena mol yang tersisa adalah mol HCl dan HCl termasuk jenis asam kuat, maka pH campuran didasarkan pada mol sisa HCl.
Penentuan pH
Vlarutan=V HCl+V NH3
=100 mL+50 mL
=150 mL
[HCl]=Vlarutanmol HCl sisa
=150 mL0,04 mmol
=2,67×10−4 M
[H+]=a×[HCl]
=1×2,67×10−4 M
=2,67×10−4 M
pH=−log [H+]
=−log(2,67×10−4 )
=4−log2,67
Maka pH akhir dari larutan campuran adalah 4−log2,67.