Perkembangan Model Atom
- Model Atom John Dalton (1803)

Atom merupakan partikel terkecil suatu materi yang berbentuk bola pejal.
- Model Atom J. J. Thomson (1897)

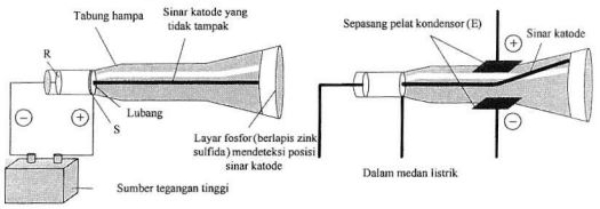
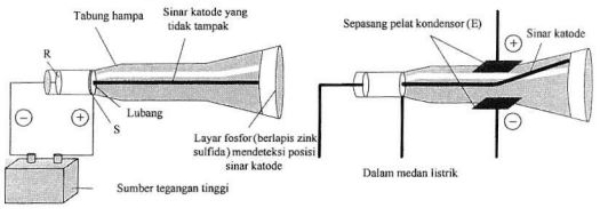
Berdasarkan percobaan menggunakan sinar katoda, Thomson menemukan adanya pembelokan sinar katoda oleh muatan listrik ke arah kutub positif. Berdasarkan percobaan tersebut, Thomson berkesimpulan bahwa sinar katoda merupakan partikel penyusun atom yang bermuatan negatif yang selanjutnya disebut elektron. Berdasarkan hal ini maka menurut Thomson, atom merupakan bola pejal yang bermuatan positif dan elektron di seluruh bagian atom seperti roti kismis.
- Model Atom Rutherford (1910)

Berdasarkan percobaan penembakan lempengan tipis emas dengan partikel alfa, Rutherford menemukan bahwa sebagian besar partikel alfa dapat menembus lempengan emas, partikel alfa yang mendekati inti atom dibelokkan gaya tolak inti dan yang menuju inti atom dipantulkan karena inti atom bermuatan positif.
Menurut Rutherford, atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif seperti tata surya.
- Model Atom Niels Bohr (1913)

Melalui percobaan mengenai spektrum atom hidrogen berhasil memberikan penjelasan bagaimana elektron-elektron berada di daerah sekitar inti atom. Menurut model atom Bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut dengan kulit elektron atau tingkat energi. Penjelasan Bohr didasarkan pada dua postulat.
- Elektron mengelilingi inti atom pada lintasan tertentu yang disebut orbit atau kulit
- Elektron dapat berpindah dari kulit yang satu ke kulit yang lain dengan memancarkan atau menyerap energi
- Model Atom Mekanika Kuantum (1926)

Model atom ini merupakan perbaikan dan pengembangan dari teori atom Bohr yang dibangun oleh beberapa ilmuwan seperti Louis de Broglie, Wolfgang Pauli, Erwin Schrodinger, dan Werner Heisenberg. Model atom ini menggambarkan sifat pergerakan elektron dan kedudukan elektron. Menurut model atom ini lintasan gerak elektron dalam atom tidak dapat ditentukan secara pasti. Hal yang dapat ditentukan adalah kebolehjadian elektron menempati ruang-ruang tertentu yang disebut orbital.
Jadi urutan nama penemu untuk model atom di atas adalah Rutherford - Werner Heisenberg - Dalton - Niels Bohr - J.J. Thomson.