Kelarutan adalah jumlah maksimum zat yang dapat dilarutkan dalam sejumlah pelarut. Kelarutan dapat dinyatakan dalam dua jenis:
- Untuk zat yang mudah larut : dinyatakan dalam gram/100 gram air.
- Untuk zat yang sukar larut : dinyatakan dalam mol/L atau kemolaran.
Diketahui:
massa AxBy = 0,15 g
Vpelarut = 1 mL = 10-3 L
Ditanya: Ksp AxBy?
Dijawab:
mol AxBy=Mr AxBym AxBy
=45 g mol−10,15 g
=3,33×10−3 mol
[AxBy]=Vpelarutmol AxBy
=10−3 L3,33×10−3 mol
=3,33 M
s=kelarutan AxBy dalam molaritas=3,33 M
Reaksi pelarutan garam AxBy
Dimisalkan kelarutan sebagai s.
AxBy(s) ⇌ xAy+(aq) + yBx-(aq)
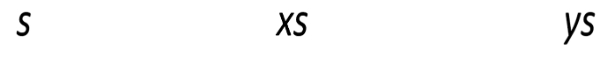
Ksp=[Ay+]x[Bx−]y
=(xs)x(ys)y
=(x(3,33))x(y(3,33))y
=(3,33x)x(3,33y)y
=(3,33)x(x)x(3,33)y(y)y
=(xx)(yy)(3,33x+y )
Maka tetapan hasil kali kelarutan dari AxBy adalah (xx)(yy)(3,33x+y).